En el laboratorio farmacéutico, al ser un sector altamente regulado, se realizan muchas actividades con el fin de cumplir con requisitos reglamentarios y obtener resultados analíticos confiables, exactos y protegidos, los cuales son base para la toma de decisiones que pueden afectar la salud de la población. En el documento Buenas prácticas cromatográficas de la OMS, publicado en abril de 2020 en el WHO Technical Report Series No. 1025, figuran recomendaciones adicionales para esta metodología de análisis tan frecuentemente utilizada, algunas de las cuales se comentan a continuación.
Sistema de datos cromatográficos (CDS)
Para asegurar la integridad de los datos analíticos y cumplir con los principios ALCOA+, se debe contar con un sistema de datos cromatográficos validado y adecuadamente configurado.
Validación
El sistema (software y hardware) debe ser adecuado para el uso previsto, con evidencia documentada de la consistencia de su funcionamiento y de la confianza y seguridad de los resultados obtenidos.
Es preferible que todos los sistemas cromatográficos estén en red, donde se almacenen y gestionen los datos en un servidor centralizado. En los sistemas individuales (stand-alone) se debe asegurar controles suficientes para disminuir los riesgos asociados.

Configuración
La configuración del sistema debe alinearse con políticas y procedimientos establecidos para la administración de los usuarios y control de acceso. Los usuarios genéricos no son adecuados y los usuarios habilitados deben corresponderse con los usuarios reales. Los privilegios deben ser los necesarios para las actividades y responsabilidades de cada usuario y no más. Por ejemplo, los analistas no deberían contar con permisos para administrar usuarios, cambiar la configuración del equipo o desactivar la configuración de seguridad establecida y aprobada.
La configuración aprobada de seguridad debe ser activada desde el momento de la instalación del software y durante toda la vida útil del equipo, por ejemplo información sobre creación, adiciones, eliminaciones o alteraciones de información y razones para los cambios (Audit Trail) y la configuración de fecha y hora sincronizada a fuente segura, confiable y no modificable.
Soluciones a analizar: viales, inyector automático y secuencia de inyecciones
En general, los procedimientos de análisis indican la metodología para la preparación y el filtrado de las soluciones a inyectar en el HPLC: soluciones estándar, soluciones muestra, solución de adecuabilidad, solución blanco, etc. Los analistas registran de manera adecuada y completa la preparación y el filtrado de las soluciones, incluyendo trazabilidad de los reactivos, material volumétrico, filtros, etc.
Las soluciones a cromatografiar deben ser utilizadas en un período definido según datos de estabilidad y validación. También deben ser almacenadas de manera adecuada, en viales que no interfieran y teniendo en cuenta, si corresponde, condiciones especiales de temperatura o protección de la luz. La USP indica que durante la verificación de los procedimientos farmacopeicos, el usuario debe demostrar la estabilidad a largo plazo (más de 24 horas) y las condiciones de almacenamiento de las soluciones estándar y muestra. Las condiciones de almacenamiento y la duración de estas soluciones deberían especificarse en el procedimiento de análisis.

Otro punto importante para tener en cuenta es que se debe mantener la trazabilidad de estas soluciones durante todo el análisis.
Para esto es necesario contar con una sistemática para la rotulación de los viales que asegure que las soluciones filtradas sigan contando con la identificación inequívoca. Debido al espacio reducido de los viales, debe establecerse claramente cuál será la nomenclatura a utilizar para no generar confusión, y cuál será el mecanismo para que se mantenga legible durante todo el análisis.
Como nos indica el documento de la OMS, los viales deben ser verificados para asegurar la secuencia correcta de inyecciones en el sistema cromatográfico antes de iniciar la secuencia de inyecciones. Para asegurar que lo que se está inyectando es la solución que realmente se quiere inyectar, se deben evitar dos posibles, y no tan poco frecuentes, errores: colocar una solución en un número de vial incorrecto en la bandeja del inyector automático, o escribir en la secuencia de la corrida del software un nombre de solución en un número de vial en el que pusimos otro vial con otra solución. Se debe entonces asegurar dos cosas antes de iniciar la secuencia de inyecciones:
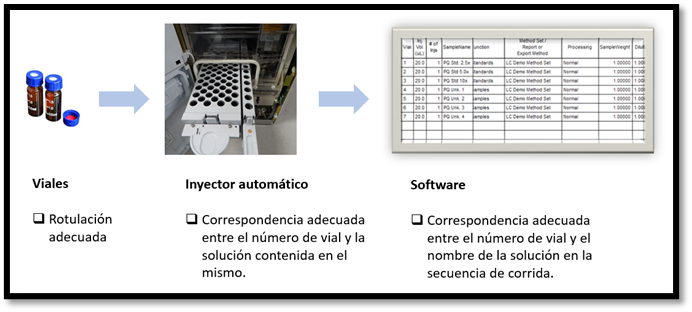
Estas tres etapas del análisis pueden afectar la integridad del dato y se pueden considerar puntos vulnerables en el flujo de información ya que no existen controles informáticos o tecnológicos y dependen altamente del analista. Esto hace necesario implementar algún control, por ejemplo, una simple verificación previa con su correspondiente evidencia, para disminuir los errores y mantener bajo control un punto que podría implicar manipulación de datos analíticos.
Los errores no intencionales en la mayoría de los casos son detectados ya que los cromatogramas obtenidos evidencian el error. Si aún luego de establecidos los controles de verificación previa al inicio de la secuencia se evidencian errores, debería establecerse la sistemática para registrar y solucionar estas posibles situaciones. Por ejemplo, puede establecerse que no se debe cambiar de lugar los viales en el inyector automático, ya que habría dos inyecciones del mismo vial con cromatogramas diferentes, y que lo correcto es corregir la secuencia en el software.
Inyecciones prueba
Como criterio general no se recomienda realizar inyecciones prueba, es decir, inyecciones previas a la verificación de la adecuabilidad del sistema, y que no formarán parte de los cálculos.
Cuando, en casos excepcionales, existen inyecciones de este tipo, deben realizarse siguiendo los lineamientos establecidos en un procedimiento aprobado donde se describa claramente la sistemática de manera justificada.
En general se realizan inyecciones prueba con soluciones estándar para evaluar el cumplimiento de parámetros de adecuabilidad del sistema como simetría, número de platos teóricos, resolución, etc., o de parámetros de concordancia entre réplicas. Las inyecciones prueba con solución muestra no son adecuadas. Si es necesario realizar inyecciones prueba con solución muestra debe estar justificado y aprobado.
Estas inyecciones forman parte del conjunto de datos del análisis y, por lo tanto, los datos correspondientes a estas inyecciones prueba deben ser tratados como los datos del resto de las inyecciones en cuanto a almacenamiento (nombre y ubicación), respaldo, reporte y revisión. Estos datos deben estar claramente identificados como inyecciones prueba y deben revisarse incluyendo, por ejemplo, comparación de forma y áreas entre las pruebas y las corridas finalmente reportadas, ya que se podría evidenciar una selección de datos para cumplir con las especificaciones.
En los documentos Warning letters de la FDA se pueden encontrar numerosas observaciones relacionadas a las inyecciones prueba. En todos los casos, la observación de la FDA no es debido a la presencia de ese tipo de inyecciones, la observación apunta a que en los procedimientos no está establecida la sistemática, o que el supervisor no las revisa, o que son guardadas en otras ubicaciones, o que se borran y no son reportadas, o que evidencian exclusión o elección de datos, o reprocesos no informados. Cada vez es más común durante una auditoría, la búsqueda de datos huérfanos, por lo que la sistemática utilizada para la gestión de este tipo de inyecciones debe estar claramente establecida, incluyendo cuáles inyecciones prueba están permitidas, en qué momento, cómo se nombran, ubican e identifican, cómo se reportan y cómo se revisan.
Referencias:
- Good chromatography practices, 54 WHO Technical Report Series, No. 1025, Annex 4, 2020
- WHO Guideline on data integrity-Working document QAS/19.819/Rev.1 June 2020
- WHO Guidance on good data and record management practices, 52 WHO Technical Report Series, No. 996, Annex 5, 2016
- USP, 〈1226〉 Verificación de Procedimientos Farmacopeicos,
- FDA Warning letters, https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters

