Las enfermedades infecciosas han constituido un problema prioritario en el área de salud. El hecho se justifica por su elevada frecuencia, la transcendencia personal y la gran demanda asistencial. Existen diferentes tipos de antibióticos, entre ellos los Fenicoles, dentro de los cuales se encuentra el Cloranfenicol.
En Cuba el Cloranfenicol liofilizado se importa de otros países con un alto valor comercial, por lo que se decide producirlo en el país. En este estudio se determinaron los parámetros de liofilización de una formulación de Cloranfenicol. Se utilizó una liofilizadora a escala de laboratorio y equipamiento para la investigación de ciclos en liofilización.
El Cloranfenicol es un antibiótico de amplio espectro producido por diversas especies del género bacteriano Streptomyces1, 2, incluyendo a S. venezuelae3. Este agente antimicrobiano es único entre los compuestos naturales ya que contiene un grupo nitrobenceno conectado a un grupo propanol, así como un grupo amino conectado a un derivado del ácido dicloroacético4 (ver figura 1). Este antibiótico es relativamente simple, razón por la que fue el primer antibiótico cuya síntesis química fue desarrollada para la producción comercial5.
Aun cuando el cloranfenicol es tóxico, en ocasiones excepcionales, se usa como antibiótico sistémico. Además, debido a que la molécula de cloranfenicol es pequeña y con características poco polares, representa una alternativa para el tratamiento de infecciones localizadas en sitios de difícil acceso, como el cerebro6.
El cloranfenicol es un antibiótico del grupo de los anfenicoles, de amplio espectro con acción bacteriostática, pero que a altas concentraciones o cuando se utiliza contra microorganismos altamente sensibles puede ser bactericida. Presenta una acción especialmente marcada sobre bacterias Gram-negativas anaeróbicas, cocos, bacilos Gram-positivos, aeróbicos y anaeróbicos. También es activo frente a espiroquetas, rickettsias, clamidias y micoplasmas.
Indicaciones terapéuticas
Se indica Cloranfenicol en la fiebre tifoidea (pero no en el estado de portador) y otras infecciones severas por Salmonella spp. Infecciones del SNC causadas por Haemophilus influenzae, Streptococcus pneumoniae y Neisseria meningitidis. Infecciones intraabdominales por bacterias anaeróbicas, incluyendo Bacteroides fragilis (en combinación con otros antibióticos). Infecciones por Rickettsias.
Mecanismo de acción
El cloranfenicol, por ser una sustancia liposoluble, difunde a través de la membrana celular bacteriana y se une reversiblemente a la subunidad 50S de los ribosomas bacterianos, donde evita la transferencia de aminoácidos a las cadenas peptídicas en formación (quizás por supresión de la peptidiltransferasa, inhibiendo de este modo la formación del enlace peptídico y la síntesis de proteína subsiguiente).
Desde la segunda mitad del siglo XIX los descubrimientos básicos de Física y Química hicieron posibles avances en el estudio del efecto de las bajas temperaturas sobre las estructuras celulares, que llevó al conocimiento de la importancia del agua para las funciones vitales de las células. El agua es causa determinante de la alteración y descomposición de productos químicos y biológicos. Es imprescindible para que se efectúe la mayor parte de las reacciones químicas enzimáticas permitiendo a su vez, el ataque por microorganismos con la consiguiente alteración en todos los casos del producto original.
Si se quiere asegurar la estabilidad de estos productos, es necesario eliminar o inactivar el agua. El método más utilizado para el secado de productos farmacéuticos es la liofilización.
La liofilización es una metodología de secado a bajas temperaturas y presiones, aplicada a productos con una estabilidad tan limitada en solución, que no resulta posible su comercialización en forma líquida. Durante el transcurso de esta operación el producto va a ser primeramente congelado, en cuya etapa se va a producir primeramente la formación y el crecimiento de los cristales de hielo y la consiguiente concentración de los solutos presentes en el sistema en la zona intersticial de dichos cristales, este paso concluye solamente cuando la movilidad en dicha zona es aproximadamente cero. El solvente se elimina, primero por sublimación (secado primario) y posteriormente por desorción (secado secundario) a niveles tales que no se afecten las propiedades físico- químicas o biológicas del producto10.
La liofilización es considerada la principal alternativa para el secado de principios activos inestables en presencia de agua y que a la vez son sensibles a la acción del calor, ya que garantiza que, al realizarse la desecación a muy bajas temperaturas, la degradación química y la pérdida de componentes volátiles se vea minimizada. Es una operación compatible con operaciones asépticas (en mayor grado que el llenado de polvos), ya que la solución puede ser filtrada inmediatamente antes del llenado.
Desde el punto de vista de estabilidad, el producto final puede ser obtenido con un porcentaje de humedad residual muy bajo, incluso por debajo del 1%, a la vez que permite inhibir considerablemente las reacciones de oxidación, ya que resulta posible realizar el tapado de los frascos bajo atmósfera de gas inerte (Ejemplo: N2) o bajo condiciones de vacío11.
El Cloranfenicol Liofilizado se quiere introducir en los laboratorios farmacéuticos cubanos con el objetivo de disminuir importaciones y abaratar los costos de los productos del sistema nacional de medicamentos.
Se reunieron cuatros especialistas de liofilización con el objetivo de establecer un ciclo de liofilización para este producto.
Objetivo
Establecer los parámetros de liofilización para la formulación del Cloranfenicol.
El estudio se realizó en una liofilizadora de investigación, modelo Lyobeta 3PS de la firma Telstar, España.
• Se utilizaron viales de 10 R, Normas DIN, vidrio hidrolítico Clase I, Nuova Ompi, Italia
• Tapón 20 mm para liofilización irradiados y estériles, West Pharmaceutical, Estados Unidos
• Sello de aluminio y plástico Flip OFF azul de 20 mm
Ciclo de liofilización
Se decide realizar una congelación a la temperatura de -12°C durante dos horas con el objetivo de igualar la temperatura del producto. Posteriormente, la temperatura de la platina alcanza los -50°C. El secado primario se realizó a la temperatura de -20°C durante 28 horas con una rampa a 0°C durante ocho horas. El secado secundario fue a 40°C durante un tiempo de 10 horas.
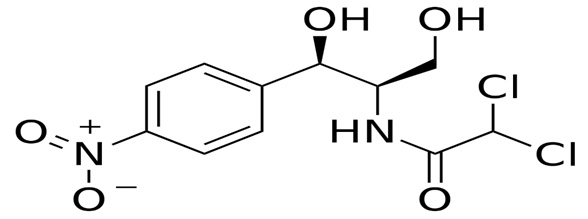
El gráfico del ciclo de liofilización propuesto por los especialistas se muestra en la figura 2.
Se realizó el test de incremento de presión al final del ciclo (≤ 20µbar) lográndose rebasar la prueba. Esto nos indica que el producto presenta un bajo porcentaje de humedad.
En la figura 2 se puede observar que el producto en el secado primario a la temperatura de -20°C por un tiempo de 20 horas no se logró eliminar toda el agua, la cual se eliminó en la rampa a la temperatura de 0°C. Se puede observar que la temperatura del producto (color verde oscuro) no alcanzó la temperatura del fluido (verde claro). El descenso del punto de roció (morado) y la disminución de los valores de presión del sensor pirani (gris) no ocurrieron durante el secado primario. Estos son parámetros que indican la eliminación de gran parte del agua en el producto durante el secado primario.
En la figura 3 se observa la foto del producto liofilizado.

En la figura 3 se puede observar que la pastilla liofilizada presenta un cambio de color de la mitad del vial hasta el fondo y grandes rajaduras en la superficie.
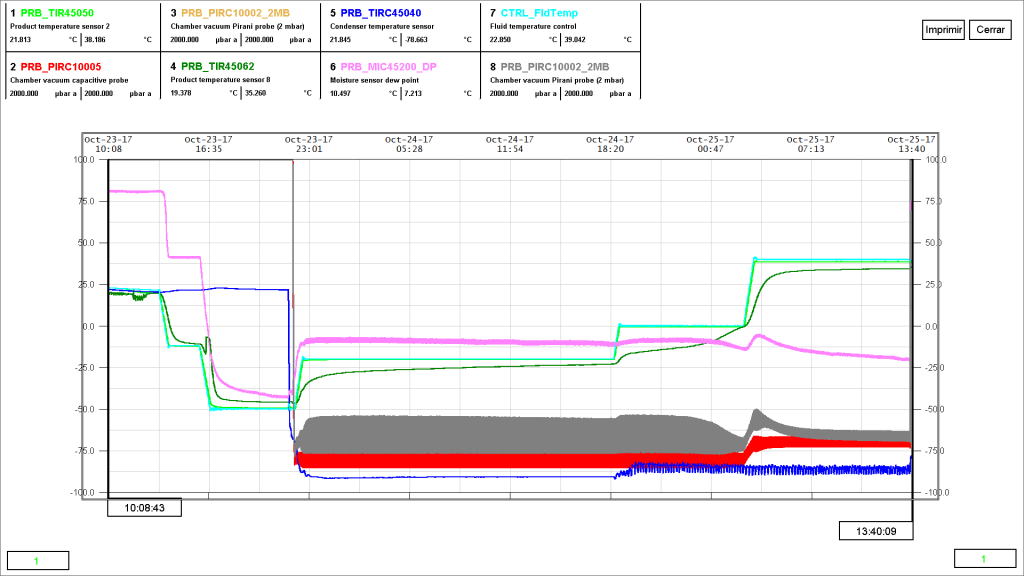
A la formulación de Cloranfenicol se le midió la Resistividad con el Eutectímetro de la Liofilizadora modelo 3PS (escala de laboratorio). Los resultados se pueden observar en la figura 4.
En la figura 4 se observa que aproximadamente a la temperatura de -31°C hay un cambio en los valores de resistividad. Esto es debido a la congelación de la mayor parte del producto. En este paso la temperatura del fluido se encontraba a -57°C. Cuando empezó a aumentar la temperatura a -29°C se observó la disminución de la resistividad del producto. Esto es debido a la descongelación de gran parte de la formulación.
Otro ensayo que se realizó a la formulación del Cloranfenicol fue el ensayo de Análisis Térmico diferencial e impedancia (ATD/Z).
Análisis Térmico Diferencial e Impedancia
El ensayo de Análisis Térmico Diferencial (ATD) e Impedancia (Z) se llevó a cabo utilizando el equipo Lyotherm2 (Biopharma Technology Ltda, Surrey, Reino Unido). El componente principal es el controlador (Lyotherm2), además componen el sistema analítico un bloque de enfriamiento/ calentamiento, en el cual se colocan las cubetas que contienen la muestra y la sustancia de referencia, y se insertan los sensores de temperatura (ATD) e impedancia (Z). La congelación de la muestra se realizó por inmersión del bloque de enfriamiento/ calentamiento en un recipiente con nitrógeno líquido, una vez que se equilibraron las temperaturas del bloque, muestra y referencia, se comenzó el calentamiento de estas.
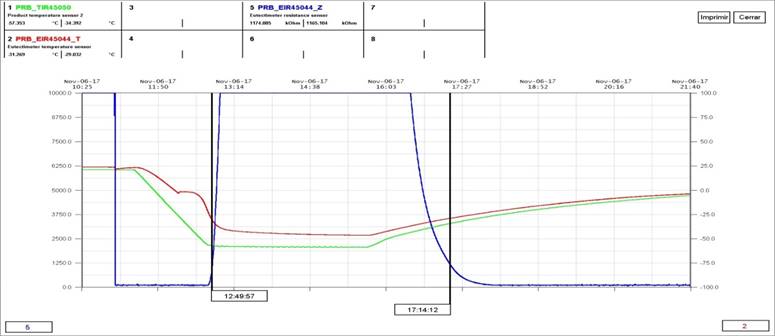
Los resultados se muestran en la figura 5.
En la figura 5. Se puede observar que a la temperatura de -49°C (verde) los valores de impedancia (Z) aumentaron, esto ocurre cuando la mayor parte del producto se encuentra congelada. Cuando se comienza a aumentar la temperatura a -17°C (morado) la impedancia fue 1, por lo que a esta temperatura el producto se encuentra totalmente descongelado. En el gráfico de Análisis Térmico Diferencial (ATD) se observa como a la temperatura de -28°C existe un punto de inflexión, esto se corresponde con el inicio del descongelamiento de la muestra.
El Cloranfenicol es un producto amorfo por lo que estos ensayos no son exactos. No obstante, la etapa de congelación se mantuvo a una temperatura de -50°C.
Según los resultados de los ensayos de ATD/Z, Eutectímetro y el primer ciclo de liofilización realizados anteriormente, se decidió por los especialistas en liofilización diseñar un nuevo ciclo de liofilización.
Segundo Ciclo de liofilización
En el segundo ciclo de liofilización se realizó una rampa a -35°C para que todo el producto alcance la misma temperatura a la misma velocidad. Después de dos horas el producto se congeló a la temperatura de – 50°C durante cinco horas. En el secado primario la temperatura fue de – 10°C durante 30 horas con una rampa en 0°C de tres horas. El secado secundario se realizó a una temperatura de 40°C durante 12 horas.
El grafico del segundo ciclo de liofilización se muestra en la figura 6.
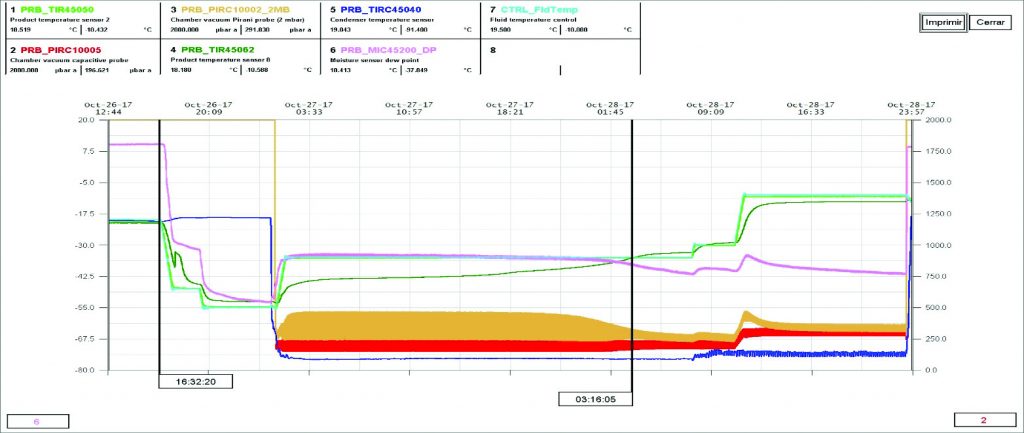
En la figura 6 se puede observar que el producto en el secado primario a la temperatura de -10°C por un tiempo de 30 horas se logró eliminar toda el agua. La temperatura del producto (color verde) alcanzó la temperatura del fluido antes de transcurrido las 30 horas. El punto de roció comenzó a descender y los valores de presión en el sensor pirani también disminuyeron durante el secado primario. Estos parámetros nos indican la eliminación de aproximadamente el 90% del agua en los viales. El agua restante es la que se encuentra ligada al producto y se elimina durante en el secado secundario.
Se realizó el test de incremento de presión al final del ciclo (≤ 20 µbar) lográndose rebasar la prueba. Esto nos indica que el producto presenta un bajo porcentaje de humedad.
En la figura 7 se observa una foto del producto liofilizado.

En la figura 7 se puede observar que la pastilla liofilizada se encuentra de color blanco y no hay presencia de rajaduras en la superficie.
Cada lote liofilizado fue almacenado en una cámara fría con una temperatura de 4 ± 2°C.
Tiempo de reconstitución
Al producto liofilizado de cada ciclo se le realizó el estudio de tiempo de reconstitución, ver tabla 1.
El estudio del reconstituido se realizó a temperatura ambiente, se utilizaron el lote 1 y lote 2, los cuales fueron reconstituidos en 5 mL de agua para inyección. Se realizaron cinco réplicas por cada muestra.
El tiempo de reconstitución es una de las propiedades físico-químicas más importantes de los productos liofilizados, para su determinación se procedió a reconstituir las variantes liofilizadas con 5 mL de agua para inyección. Los resultados obtenidos se muestran en la tabla 1.
Estudio de tiempo de reconstitución
Lotes Tiempo de reconstitución (Minutos)
1 (primer ciclo) 4,73 ± 0,5
2 (segundo ciclo) 4,29 ± 0,3
Tabla1. Tiempo de reconstitución del Cloranfenicol liofilizado en 5 ml de agua para inyección.
| Estudio de tiempo de reconstitución | |
| Lotes | Tiempo de reconstitución (Minutos) |
| 1 (primer ciclo) | 4,73 ± 0,5 |
| 2 (segundo ciclo) | 4,29 ± 0,3 |
Como se muestra en la tabla 1. El lote 1 presenta mayor tiempo de reconstitución que el lote 2. Estas diferencias de tiempo en los resultados no son significativos.
Determinación de humedad residual (Karl Fisher)
El ensayo se realizó empleando un electrodo doble de platino. Se tomó una cantidad suficiente de muestra y se le inyectó 1 mL de metanol, se agitó aproximadamente por tres minutos. Aplicando la siguiente fórmula se determinó el contenido de humedad presente en la muestra, expresando el valor promedio de tres réplicas.
X = (C – B) F x K/M
Dónde:
X: contenido de humedad del producto (%)
C: volumen de solución Karl Fischer consumido por la muestra (mL)
B: volumen de solución Karl Fischer consumido por el blanco (mL)
F = factor (mg/mL)
K = factor matemático para los cálculos, que es igual a 100 para sólidos o liofilizados
M = masa de la muestra
En los resultados que se expresan en la tabla 2.
| Humedad Residual (%) | |
| Lote 1 | Lote 2 |
| 4.8 ± 0.3 | 1.5 ± 0.2 |
Tabla 2. Humedad Residual de las variantes liofilizadas.
Se puede apreciar que el lote 1 presentó una humedad residual mayor al lote 2. Estos resultados coinciden con la disminución del punto de rocío y la disminución de los valores de presión en el sensor pirani en la cámara, durante el secado primario en el ciclo 2. Ver figura 6.
Conclusiones
• La temperatura en la congelación del producto debe ser ≥ -50°C con una rampa previa a los – 35°C.
• En el secado primario a la temperatura de -10°C fue removido aproximadamente el 90% del agua contenida en los viales.
• El secado secundario se fijó a una temperatura de 40°C.
• Organolépticamente, las pastillas liofilizadas en el ciclo 2 fueron superior a las pastillas liofilizadas en el ciclo 1.
• Los tiempos de reconstitución de los dos ciclos no presentan diferencias significativas.
• El Cloranfenicol liofilizado en el ciclo 2 presentó un porcentaje de humedad más bajo que el Cloranfenicol liofilizado en el ciclo 1.
• Los parámetros del ciclo 2 de liofilización fueron los establecidos para el proceso de liofilización del Cloranfenicol.
Referencias bibliográficas
- Ehrlich J., Bartz Q. R., Smith R. M., Joselyn A. A. 1947. Chloramphenicol a new antibiotic from soil Actinomycetes. Science, 106(2757):417.
- Vining L. C., Westlake D. W. S. 1984. Chloramphenicol: properties, biosynthesis and fermentation. En Vandamme S. J. (Ed.), Biotechnology of Industrial Antibiotics. Marcel Dekker New York, pp. 387-411.
- Bartz Q. R. 1948. Isolation and characterization of chloromycetin. The Journal of Biological Chemistry, 172(2):445-450.
- Powell D. A., M. C. Nahata. 1982. Chloramphenicol: new perspectivas on an old drug. Drug Intelligence and Clinical Pharmacy, 16(4):295-300.
- Yolanda Elizabeth Morales G., Ma. Carmen Herrera, Jesús Muñoz R. Chloramphenicol, a classic antibiotic as an alternative for the present. Revista Mexicana de Ciencias Farmacéuticas, vol. 38, núm. 1, enero-marzo, 2007, pp. 58-69.
- Thea D., Barza M. 1989. Use of antibacterial agents in infections of the central nervious system. Infectious Disease Clinics of North America, 3(3):553-570.
- Yolanda Elizabeth Morales G., Ma. Carmen Herrera, Jesús Muñoz R. Chloramphenicol, a classic antibiotic as an alternative for the present. Revista Mexicana de Ciencias Farmacéuticas, vol. 38, núm. 1, enero-marzo, 2007, pp. 58-69.
- Bhuta P., Chung H. L., Hwang J.-S., Zemliacka J. 1980. Analogues of chloramphenicol: circular dichroism spectra, inhibition of ribosomal peptidyltransferase, and possible mechanism of action. Journal of Medicinal Chemistry, 23(12):1299-1305.
- Michelinaki M., Mamos P., Coutsogeorgopoulos C., Kalpaxis D. L. 1997. Aminoacyl and peptidyl analogs of chloramphenicol as slow-binding inhibitors of ribosomal peptidyltransferase: a new approach for evaluating their potency. Molecular Pharmacology, 51(1):139-146.
- Amoignon, J.; LE FLOC´H,L.; Principios generales de la Liofilización de Productos biológicos y Farmacéuticos. USIFROID. 2000. p. 28-49.
- Geankoplis, Christie J. Procesos de transporte y operaciones unitarias 3ª Edición. Compañía Editorial Continental. 2005. México D.F.
MSc. Yasser Zárate Rivera
Licenciado en Ciencias Farmacéuticas
Químico Farmacéutico
Máster en Tecnología y Control de Medicamentos
Lic. Laura Collazo Toledo
Lic. Germán Aguila Pérez
Ing. Alejandro García Varona
MSc. Marilyn Pérez Calixto

